DOSSIER HHC : POSITION RÉGLEMENTAIRE ET INTERPRÉTATION
FÉVRIER 2023
Auteurs : LEGALITE Florent (PhD), BOISSEAU Renaud (PhD), WARRICK William (chargé d’affaires réglementaires)
LABOSTARK, 4 rue des Savoir-Faire, 44450 SAINT-JULIEN-DE-CONCELLES
——————————————-
ABSTRACT :
Le HHC1 est un cannabinoïde dont la présence sur le marché Français n’est pas passée inaperçue. Face aux nombreuses interrogations des consommateurs de CBD et fausses croyances, une mise en lumière de cette substance semble nécessaire.
Dans ce document technique a visée d’information, la position réglementaire du gouvernement est étudiée et la position claire du laboratoire LABOSTARK vis-à-vis de cette molécule est explicitée et ce dans le but de conseiller le consommateur, mais également le professionnel.
—————————————–
CONTEXTE
Les cannabinoïdes sont des substances qui proviennent majoritairement de la plante Cannabis sativa L. (famille végétale des cannabinacées) [RADWAN, 2021]. Bien qu’il s’agisse de l’une des plus anciennes plantes cultivées pour l’alimentation, ses fibres ou encore la médecine, l’état de l’art disponible mets en exergue des connaissances parcellaires sur ses substances et leurs interactions avec le corp humain et impliquant divers processus physiologiques notamment.
Le CBD est un phyto-cannabinoïde abondant dans la plante qui a été identifié en 1940 [ADAMS (a), 1940], [ADAMS (b), 1940] et qui est démontrée comme non-psychotrope [PENG, 2022]. Le Δ9-THC est quant à lui un phyto-cannabinoïde analogue au CBD mais largement reconnut comme molécule stupéfiante pour ses effets psychoactifs par l’académie scientifique [MILLER, 2020], ainsi que par les autorités en France.
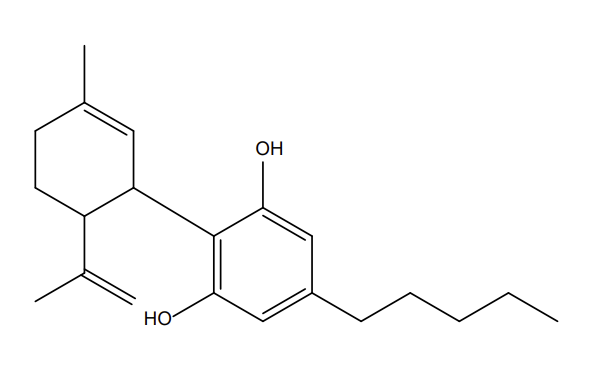
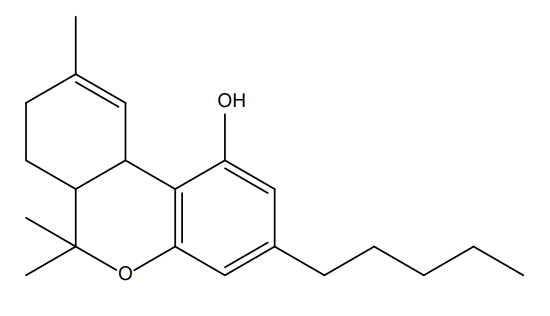
Figure 1 : Structure chimique respective du cannabidiol (a) et du tétrahydrocannabinol (b)
En France, la liste des stupéfiants et psychotropes est générée par l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) : https://ansm.sante.fr/documents/reference/autres-produits-de-sante. Les molécules dérivées des tétrahydrocannabinols (leurs esters, éthers, sels ainsi que les sels des dérivés) y sont clairement inscrites dans l’« arrêté du 22 février 1990 fixant la liste des substances classées comme stupéfiants_version consolidée du 1er janvier 2020 » :
Sont classées comme stupéfiants les substances et préparations mentionnées dans les annexes au présent arrêté.
Tétrahydrocannabinols, leurs esters, éthers, sels ainsi que les sels des dérivés précités
Figure 2 : Extraits de l’« arrêté du 22 février 1990 fixant la liste des substances classées comme stupéfiants_version consolidée du 1er janvier 2020 »
Qu’en est-il du HHC ?
Si jusqu’ici aucune ambiguïté ne persiste concernant le Δ9-THC (ou encore le Δ8-THC), le HHC est au cœur du débat dans la sphère des consommateurs et professionnels du CBD.
Afin de comprendre son (futur) statut, il est nécessaire de comprendre la chimie et les structures moléculaires pour interpréter l’arrêté cité précédemment.
DÉFINITION DU HHC (des HHCs)
Présent en quantité infinitésimale parmi une liste importante de cannabinoïdes (dont le CBD2 ou encore le THC3) dans la plante Cannabis sativa L., le HHC (découvert en 1944) appartient à la famille des cannabinoïdes naturellement disponible dans le chanvre [ADAMS, 1947]. Toutefois, cette substance n’est pas exploitable naturellement au vu du faible rendement de son extraction (en corrélation avec les très faibles quantités de cette substance dans la plante).
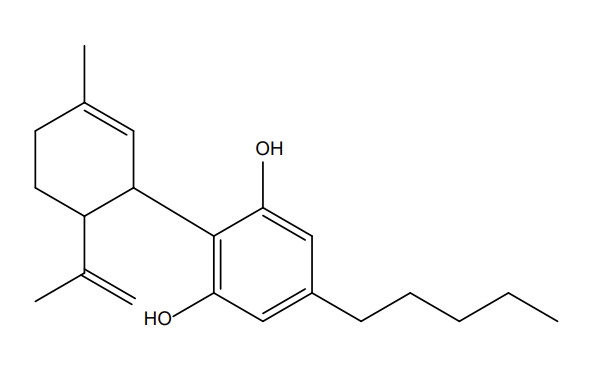
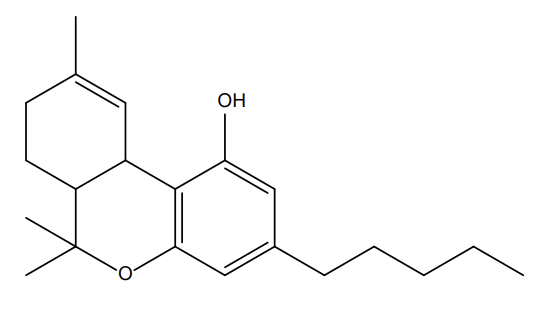
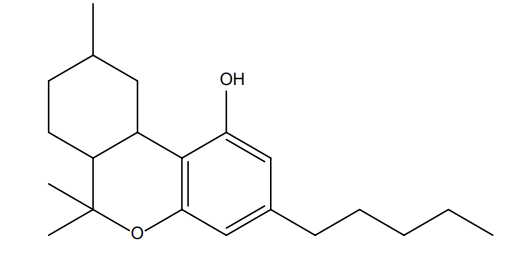
Figure 3 : Comparaisons structurales entre cannabidiol (a), tétrahydrocannabinol (b) et l’hexahydrocannabinol (c)
Pour exploiter cette molécule, les chimistes empruntent la voie de la synthèse organique totale (ou partielle par utilisation de l’hémisynthèse4). Pour ces raisons, les produits à base de HHC présents sur le marché sont d’origine synthétique.
Chimiquement, il est important de souligner qu’il existe plusieurs molécules de HHC dont une forme (R) et une forme (S) relatif à l’existence de carbones dits asymétriques sur le cycle hexyl de la molécule de HHC comme l’illustre la figure ci-dessous :
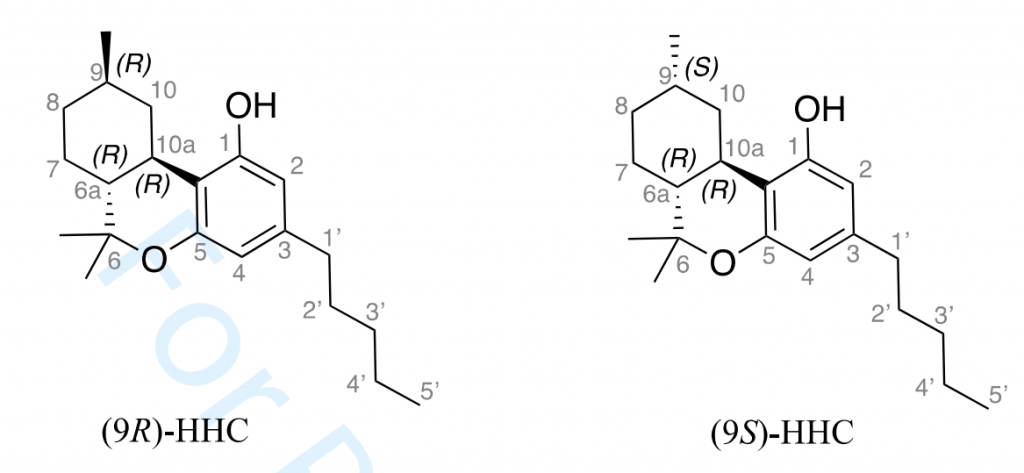
Figure 4 : Structures chimiques des deux diastéréoisomères (9R)-HHC et du (9S)-HHC [CASATI, 2022]
PROPRIÉTÉS TOXICOLOGIQUES
En premier lieu, le parcours de la littérature scientifique la plus récente (2022) démontre un manque de connaissance évident des effets de cette substance sur l’organisme tant sur le plan activité, que son potentiel, sa toxicité ou encore la sécurité [CASATI, 2022]. L’équipe de CASATI et al. a reporté néanmoins une affinité plus importante du (9R)-HHC par a son isomère (9S)-HHC avec les récepteurs endocannabinoïdes 1 et 2 (le Δ9-THC se lie à ces même récepteurs).
Bien que des études préliminaires in-vitro non-clinique ont été réalisées (et se poursuivent) par A. COLLINS, il a été observé des effets cytotoxiques potentiels sur des tissus de poumon humain alors qu’aucun effet négatif a été démontré sur des cellules de foies humain [COLLINS, 2022]. Or, nous savons que la consommation et l’absorption de cette molécule se fait principalement par inhalation (post-combustion). L’auteur conclut finalement que cette molécule, même si entièrement synthétisée, dispose d’un intérêt fort pour la recherche, démontrant le manque de connaissance de cette molécule, ce qui devrait alerter aujourd’hui sa consommation par les particuliers.
Pour information : Ce constat est d’autant plus important que l’existence de diastéréoisomères du HHC dans les produits consommés actuellement peuvent conduire a des effets indésirables et non reproductibles d’un produit à l’autre car la maitrise du ratio entre la forme (9R)-HHC et (9S)-HHC est inexistant. En effet, chaque stéréoisomère dispose de son propre effet. Dans le meilleur des cas, l’un est inactif par rapport à l’autre (ou dispose d’un effet similaire), mais nous pouvons supposer que l’un puisse être toxique par rapport à l’autre. Les sciences chimiques nous ont déjà démontré cette observation comme avec le célèbre médicament : le thalidomide. Cette substance dispose d’un carbone asymétrique (comme les HHCs) et d’un effet sédatif sous sa forme R (protège notamment des nausées), tandis que la forme S présente des effets tératogènes5 délétères pour le fœtus. Des scénarios similaires peuvent être envisagés pour les (9R)-HHC et (9S)-HHC.
Des études sur cultures cellulaires (et modèles animaux) ont souligné le potentiel antitumoral des HHCs et ses analogues en exprimant toujours leurs limites vis-à-vis des effets indésirables psychoactifs freinant le développement de traitements en ce sens [THAPA, 2011].
EFFETS/INTÉRÊTS DES HHCS
Les HHCs ont une similarité structurale étroite avec le tétrahydrocannabinol. Cependant, scientifiquement, peu d’études permettent de leur attribuer des effets concrets. La psychoactivité de la molécule est souvent abordée dans les études par interaction avec les mêmes récepteurs (CB1 et CB2) que le THC, d’où l’attribution d’effets proches de la molécule de THC [AGOSTI, 2022]. De cette même conférence des cannabinoïde qui s’est tenue en 2022, il est souligné une expérimentation comportementale sur le singe qui démontrerais que le (9R)-HHC serait deux fois moins actif que le Δ9-THC.
De façon générale, les conclusions sont unanimes, les HHCs sont sous-étudiées aujourd’hui. Quelques études de métabolisations chez l’animal sont reportées, mais « la pharmacologie humaine du HHC est pratiquement inconnue. D’autres évaluations pré-cliniques et études cliniques sont nécessaire pour explorer le spectre complet de l’activité biologique et le potentiel thérapeutique du HHC » [AGOSTI, 2022].
SYNTHÈSE DU HHC
Plusieurs voies de synthèses existent selon la complexité de mise en place, de rendement ou de pureté attendue. La voie de synthèse privilégiée pas sa simplicité reste l’hémisynthèse du HHC à partir de l’extraction du THC de la plante de cannabis ou encore à partir du CBD [SAMS], [MEEHAN-ATRASH, 2021]. Avec comme point de départ le THC, une unique étape d’hydrogénation et purification suffit à produire la molécule de HHC :
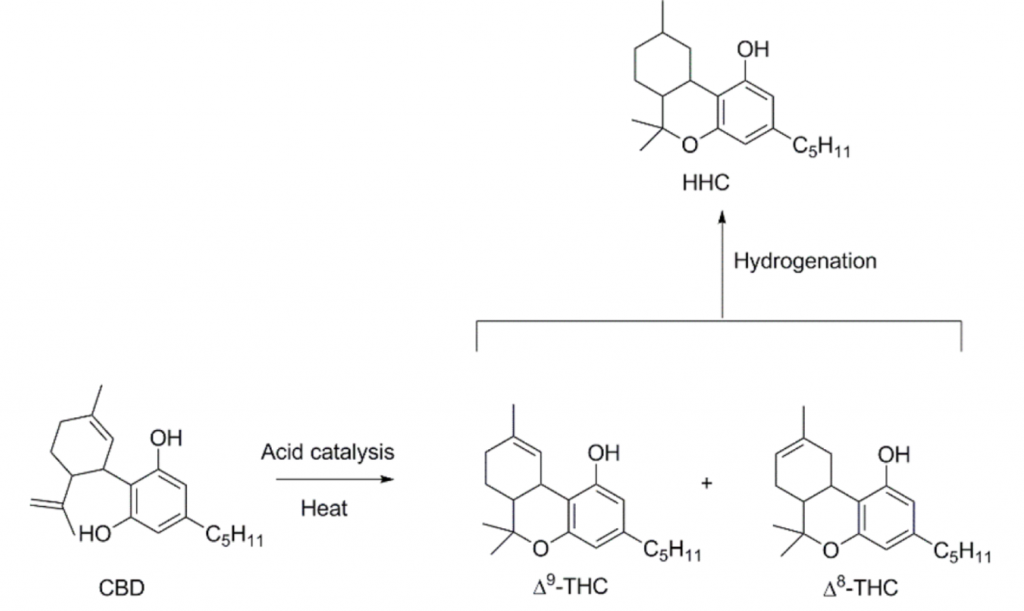
Figure 5 : Schéma réactionnel de l’obtention du HHC [MEEHAN-ATRASH, 2021]
Concrètement, la figure 5 illustre le schéma réactionnel de la synthèse du HHC via le CBD en tant que matière première. De l’acide paratoluènesulfonique est additionné au CBD et le milieu réactionnel est portée à température pour former du Δ9-THC et du Δ8-THC. A partir de ce mélange, plusieurs réactions d’hydrogénations sont possibles. Les plus communes sont :
- L’utilisation du catalyseur d’Adam qui consiste à additionner une solution d’acide acétique contenant de l’oxyde de platine pour hydrogéner les doubles liaisons sur le cycle non aromatique (position 9) ;
- L’hydrogénation par utilisation soit du Nickel de Raney supporté sur charbon, ou du palladium supporté sur charbon (en pratique, il s’agit de la voie de synthèse à privilégier car la purification du THC avant l’hydrogénation n’est pas nécessaire).
Un exemple de synthèse totale à partir d’un réactif initial disponible (l’olivetol) est illustré ci-dessous démontrant la complexité d’utiliser cette voie pour synthétiser la molécule car une purification est nécessaire à chaque étape amenuisant les rendements par la succession des opérations [WANG, 2000] :
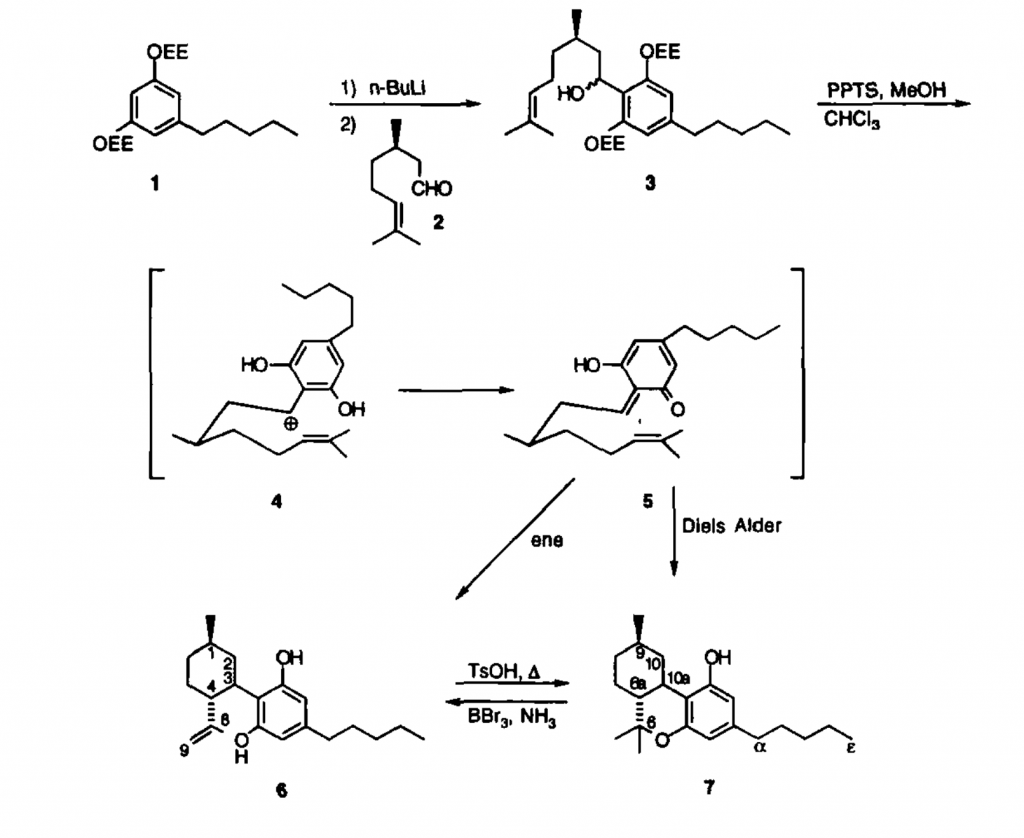
Figure 6 : Schéma réactionnel en synthèse total du HHC (7) [WANG, 2000]
De façon globale, ces voies de synthèse, si mal exécutées, génère en fin de production :
- Résidus de solvants (acide acétique, acide paratoluènesulfonique, etc.) ;
- Traces de métaux (Palladium ou Nikel ou du Platine) ;
- Autres (dans le cadre de la synthèse totale ; il est possible de trouver des composés organo-lithiés, méthanol, chloroforme, résidus de colonne de chromatographie, etc.).
La majorité des produits contenant du HHC vendus sur le commerce étant très peu documentée sur le mode de fabrication et de purification, il semble aujourd’hui dangereux de consommer ce type de produits.
CADRE RÉGLEMENTAIRE
En étudiant plus profondément l’arrêté du 22 février 1990 fixant la liste des substances psychotropes (version consolidée du 24 novembre 2020), le THC est indiqué de façon claire. Concernant le HHC, la structure chimique de la molécule doit être étudiée et des connaissances de base en chimie sont indispensables pour comprendre cet arrêté (Figure 7).
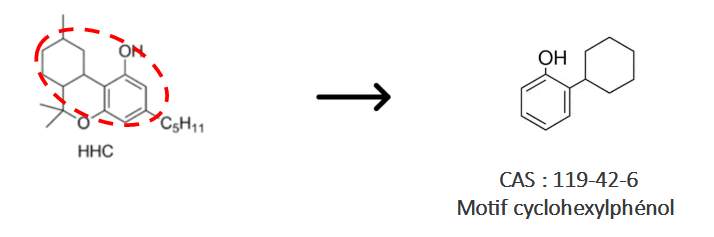
Figure 7 : Etude des motifs structuraux cyclohexylphénols sur le HHC
La superposition des deux structures illustrées en figure 7 démontre bien que le HHC dispose d’un motif cyclohexylphénol. Il ne s’agit pas d’une « ressemblance » mais bien du motif qui figure dans l’arrêté du 22 février 1990 :

Figure 8 : Extrait de l’arrêté du 22 février 1990
Le substitue en position 5 est bien présent (cf. voir la figure 4 pour comprendre la numérotation des positions).
CONCLUSION
Ce document a vocation à informer le consommateur, ainsi que les professionnels du secteur du CBD qui distribue des produits à base de HHC sur les propriétés de cette substance.
Cet écueil technique intervient à la lueur des nombreux questionnements soumis à LABOSTARK (clients et autres) et a été rédigé en ce sens, en s’appuyant sur des références scientifiques.
Bien qu’une clarification sur le statut réglementaire soit attendue, la première interprétation de l’arrêté du 22 février 1990 est claire d’un point de vue scientifique : le HHC est un dérivé de cyclohexyphénols avec un substitut en position 5 du noyau phénol, donc ce dernier est concerné par cet arrêté. Il est par conséquent considérable à un stupéfiant.
Nous attirons l’attention sur la gravité pour le particulier ou le professionnel de détenir des stupéfiants du point de vue du législateur. Il est notamment question de sanctions pénales qui sont très lourdes, surtout pour les « grossistes ». Des peines de prison peuvent atteindre 5 ans et une amende de 75 000 € d’amendes. Une requalification en « gros trafiquants » va bien au-delà de ces peines.
La position du laboratoire LABOSTARK (et ce peu importe l’issue réglementaire) est de ne pas distribuer, ni même consommer cette substance dont les effets sont encore trop méconnus scientifiquement. De plus, sa synthèse faisant appel à des produits intermédiaires dangereux, nocifs, voire CMR6 (et les moyens de purification étant à ce jours inconnus car non mis à disposition par les distributeurs), des effets secondaires inattendues peuvent être présagés. La plus grande méfiance est donc de guise.
BIBLIOGRAPHIE
ADAMS, Roger. Marihuana. Science, 1940, vol. 92, no 2380, p. 115-119 (a).
ADAMS, Roger, HUNT, Madison, et CLARK, J. H. Structure of cannabidiol. III. Reduction and cleavage. Journal of the American Chemical Society, 1940, vol. 62, no 4, p. 735-737 (b).
ADAMS, Roger. Marihuana active compounds. Patent n°US 2419937, 1947.
AGOSTI, Reto, BRENNEISEN, Rudolf, BROERS, Barbara, et al. Cannabinoid Conference 2022 12th IACM Conference on Cannabinoids in Medicine 1st SSCM Conference on Cannabis in Medicine. Abstracts of Poster Presentations P1 until P, vol. 43, p. 162. 2022.
CASATI, Sara, ROTA, Paola, BERGAMASCHI, Roberta F., et al. Hexahydrocannabinol on the Light Cannabis Market: The Latest “New” Entry. Cannabis and Cannabinoid Research, 2022.
COLLINS, Arianna C., TESFATSION, Tesfay T., RAMIREZ, Giovanni A., et al. Nonclinical In Vitro Safety Assesment Summary of Hemp Derived (R/S)-Hexahydrocannabinol ((R/S)-HHC). Research Square. 2022.
MEEHAN-ATRASH, Jiries et RAHMAN, Irfan. Cannabis vaping: existing and emerging modalities, chemistry, and pulmonary toxicology. Chemical research in toxicology, 2021, vol. 34, no 10, p. 2169-2179.
MILLER, Henry P., BONAWITZ, Steven C., et OSTROVSKY, Olga. The effects of delta-9-tetrahydrocannabinol (THC) on inflammation : A review. Cellular Immunology, 2020, vol. 352, p. 104111.
PENG, Jiangling, FAN, Mingjie, AN, Chelsea, et al. A narrative review of molecular mechanism and therapeutic effect of cannabidiol (CBD). Basic & Clinical Pharmacology & Toxicology, 2022, vol. 130, no 4, p. 439-456.
RADWAN, Mohamed M., CHANDRA, Suman, GUL, Shahbaz, et al. Cannabinoids, phenolics, terpenes and alkaloids of cannabis. Molecules, 2021, vol. 26, no 9, p. 2774.
SAMS, R. A., Analysis of Hexahydrocannabinols : Eliminating Uncertainty in its Identification. KCA LABS.
THAPA, Dinesh, LEE, Jong Suk, HEO, Se-Woong, et al. Novel hexahydrocannabinol analogs as potential anti-cancer agents inhibit cell proliferation and tumor angiogenesis. European journal of pharmacology, 2011, vol. 650, no 1, p. 64-71.
WANG, Tiansheng, BURGES, Jason P., REGGIO, Patricia H., et al. Mild generation of o-quinone methides. Synthesis of (-)-hexahydrocannabinol and dihydrocannabidiol. Synthetic Communications, 2000, vol. 30, no 8, p. 1431-1435.
Glossaire
1 HexaHydroCannabinol
2 CannaBiDiol
3 TetraHydroCannabinol
4 Synthèse organique d’un composé final à partir d’une substance d’origine naturelle en tant que matière première
5 Substance susceptible de provoquer des malformations congénitales chez les enfants exposés in utero (le fœtus)
6 Cancérigène, Mutagène, Reprotoxique